شغل التلاعب في الجينات، البشر منذ اكتشاف الحضارات القديمة، إذ أن صفات المحاصيل والحيوانات بل والبشر أنفسهم متوارثة، فيما عزز رسم الخريطة الجينية البشرية حديثًا قدرة العلماء على تحديد الجينات المسؤولة عن كل صفة بدقة، وبالتالي تعديل شيفرات "الحمض النووي" (DNA) الخاصة بها مباشرة.
ومع مرور السنين، تبيّن أن هذه الأساليب مضنية وقد تخطئ أو تصيب، إلى أن ظهرت تقنية التعديل الجيني "كريسبر- كاس 9" (Crispr-Cas9) أو "كريسبر" (Crisper) اختصارًا، والتي أصبحت حديث الوسط العلمي بل وغيّرت ملامح علاقتنا مع الجينات نظرًا لبساطتها وانخفاض تكلفتها وكفاءتها العالية.
ويتوقع القائمون على تقنية التعديل الجيني أن تسهم مثل هذه النقلة النوعية في علم الجينات في السيطرة على الآفات وزيادة معدل إنتاج الأغذية والقضاء على الأمراض التي تُصيب البشر، دون أن يخفوا قلقهم من إمكانية استخدامها في إنتاج أطفال مهندسين جينيًا أو إحداث طفرات خطيرة أو تصميم أسلحة بيولوجية قادرة على استهداف شعوب معينة.
الوضع الحالي
أثار الباحث الصيني "خه جيان كوي" (He Jiankui) جدلًا واسعًا في شهر نوفمبر 2017 عندما ادّعى أنه قام بإنتاج أول أطفال مُعدّلين وراثيًا في العالم، مشيرًا إلى أنه استخدم تقنية "كريسبر" لتعديل جينات زوج من التوائم حين كانا لا يزالان أجنة، وذلك لمنحهما القدرة على مقاومة فيروس نقص المناعة المكتسبة (الإيدز).
وسُرعان ما أثار هذا الإعلان انتقاد خبراء آخرين في هذا المجال، لأن مثل هذا التعديل باستخدام تقنية "كريسبر" على الأجنة والخلايا الجرثومية – كالسائل المنوي والبويضات المُلقّحة وغير الملقحة يعني استمرار انتقالها من جيل إلى آخر. وبعد دراسة متأنية لمدة عام كامل، قرّرت مجموعة استشارية أمريكية في مجال العلوم والطب دعم البحوث التي تستخدم تقنيات مثل "كريسبر" في تعديل الأجنة البشرية للوقاية من الأمراض والإعاقات الخطيرة.
ورغم ازدياد عدد المختبرات التي توجهت لاستخدام تقنية "كريسبر" في إجراء تجارب تتضمن تعديل جينات الخلايا الجرثومية، إلّا أن استخدام التقنية في تطبيقات أخرى لا يزال أكثر شيوعًا، مثل استخدامها في قتل البعوض الحامل لفيروس الملاريا وإنتاج قمح مقاوم لآفة البياض الدقيقي، وإنتاج بيض يُناسب الأشخاص الذين يعانون من حساسية تجاهه، وإعادة إحياء حيوان الماموث المُنقرض.
واستخدم الباحثون تقنية "كريسبر" فيما يتعلق بالاختبارات على الخلايا البشرية، لإصلاح الطفرة الجينية المُسببة للعمى، وتصحيح الخلل المسؤول عن التليّف الكيسي. ثم في أواخر عام 2015، نشر الباحثون نتائج تُظهر نجاح هذه التقنية في علاج الحيوانات البالغة، إذ تمكنّوا من إصلاح جين معيب في الفئران التي تعاني من الضمور العضلي الدوشيني ما ساعد هذه الحيوانات على استعادة قوتها العضلية بمرور الوقت.
وأجريت أول تجربة على البشر في الصين عام 2016 حيث استُخدمت تقنية "كريسبر" في تعديل خلايا الدم البيضاء التائية من أجل علاج مرضى سرطان الرئة، وفي نهاية عام 2018، بدأت عملية استقطاب متطوعين يعانون من أمراض في الدم، كفقر الدم المنجلي وبيتا ثلاسيميا، للانضمام إلى دراسة سريرية في أوروبا.
من ناحية أخرى، كشفت دراستان نُشرتا في مُنتصف عام 2018 أن الخلايا التي يتم تعديلها بواسطة "كريسبر" يمكن أن تساهم في تحفيز نشوء الأورام في الجسم ما قد يزيد من خطر الإصابة بالسرطان، غير أن العلاقة بينهما لا تزال قيد البحث والدراسة.
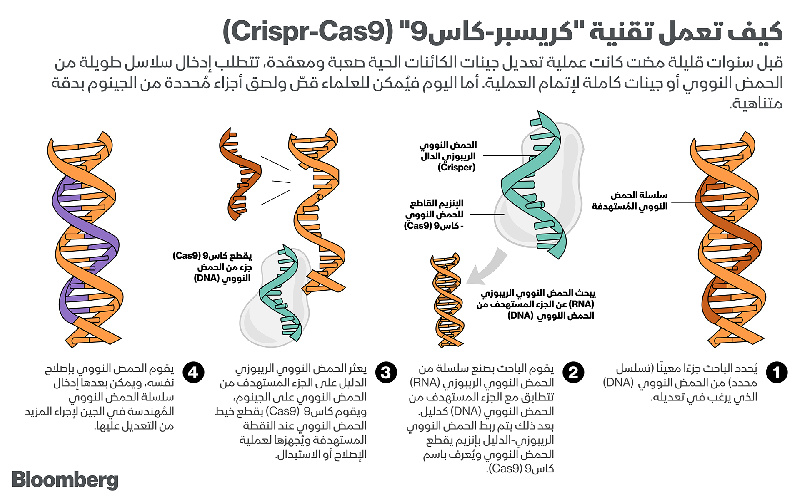
وببساطة فإن "كريسبر-كاس9" نظام مناعي بدائي في البكتيريا اكتشفه علماء يابانيون قبل حوالي 30 عامًا، وأُطلق عليه هذا الاسم اختصارًا لـ (التكرارات العنقودية المتناوبة منتظمة التباعد) في إشارة إلى تسلسلات من الشيفرات الجينية انفصلت عن بقايا جينات خلفت وراءها الفيروسات التي تغزو البكتيريا.
تُساعد هذه التسلسلات البكتيرية في التعرّف على الحمض النووي في حال تعرضها للغزو مرة أخرى فتسارع إلى إطلاق إنزيم كاس9 (Cas9) الذي يعمل بدوره على قطعه. ولم يتمكن العلماء من فهم آلية عمل تقنية "كريسبر" في قص أجزاء الحمض النووي واستبداله بشكل وافٍ حتى عام 2012، عندما قام باحثون في "جامعة كاليفورنيا" في بركلي (University of California) بنشر ورقة علمية تناولت صنع جزيئات تعمل "كدليل" يساعد تقنية "كريسبر" على استكشاف الحمض النووي واستهداف الجُزء المطلوب قصه بدقة.
لم يمض الكثير من الوقت، حتى كشف علماء في "معهد برود التابع لجامعة هارفارد" (Harvard-affiliated Broad Institute) عن تعديلهم تقنية كريسبر لاستخدامها في الخلايا البشرية، ما أدى إلى نشوب خلاف حول براءة الاختراع المتعلقة بهذه التقنية لما لها من انعكاسات على الجوائز العلمية التي قد يحصدها من تتم تسوية الخلاف لصالحه.
غير أن الخلاف حُسم في عام 2017، حين صدر قرار من "مكتب براءات الاختراع الأمريكي" (U.S. Patent Office) بأن براءات الاختراع التي قدّمها كل من "معهد برود" و"جامعة كاليفورنيا في بيركلي" مختلفة عن بعضها بشكل كافٍ لا يستوي معه النزاع، وبناءً عليه رُفض طلب الاستئناف الذي قدمته بيركلي.
ويُمكن لأي باحث يملك مهارات أساسية ومعدات لا يزيد ثمنها عن بضعة آلاف من الدولارات أن يستخدم تقنية كريسبر بسهولة، ما يفتح بابًا واسعًا للابتكار وفي نفس الوقت لإساءة الاستخدام؛ إذ أنه لا يمكن الجزم بأن تقنية "كريسبر" خالية من العيوب، على الأقل حاليًا، خاصةً وأن حوالي 60 بالمئة من عمليات قص الحمض النووي غير مقصودة، ولا يزال العلماء يجهلون آثار ذلك حتى الآن.
الجدل الدائر
لا بد من أخذ جميع المخاطر والمنافع بعين الاعتبار قبل اتخاذ قرار استخدام تقنية "كريسبر" في علاج الأشخاص المصابين بالأمراض، فالقضايا المرتبطة باستخدام تقنية التعديل الجيني في الخلايا الجرثومية ليست طبية فحسب، بل وفلسفية أيضًا.
وعلى الرغم من المنافع الجمّة لاستخدامها مثل القضاء على الأمراض الوراثية إلى الأبد، لا يمكن إغفال أن تبعات أي خطأ يحدث ستكون دائمة، نظرًا لانتقالها عبر الأجيال الذين لم يتسنى لهم منح موافقتهم المسبقة على هذا الأمر.
وفي الوقت الذي يُبدي فيه بعض العلماء قلقهم من التوجه نحو استخدام التقنية في تعديل الخلايا الجرثومية لأغراض غير طبية، مثل إنتاج أطفال بصفات محسنة، احتج على ذلك الفيلسوف "نيك بوستروم" (Nick Bostrom) والمؤلف "كارل شولمان" (Carl Shulman) في مقال صدر عام 2013 بأن الأفراد ذوي القدرات الذهنية المُعززة يمكنهم أن يساهموا في المجتمع إيجابيًا من خلال ابتكارات تعود بالنفع على الجميع.




